🚩 平位先生,横田先生研究内容
- 一口に幹細胞といっても様々な種類のものがあります。発生段階で体中のすべての細胞の起源となる多能性幹細胞としてiPS細胞や胎生幹細胞(ES細胞)などが知られており、これらの細胞が様々な細胞・組織・臓器をつくる能力を持っており、再生医療に応用可能であることから注目されています。
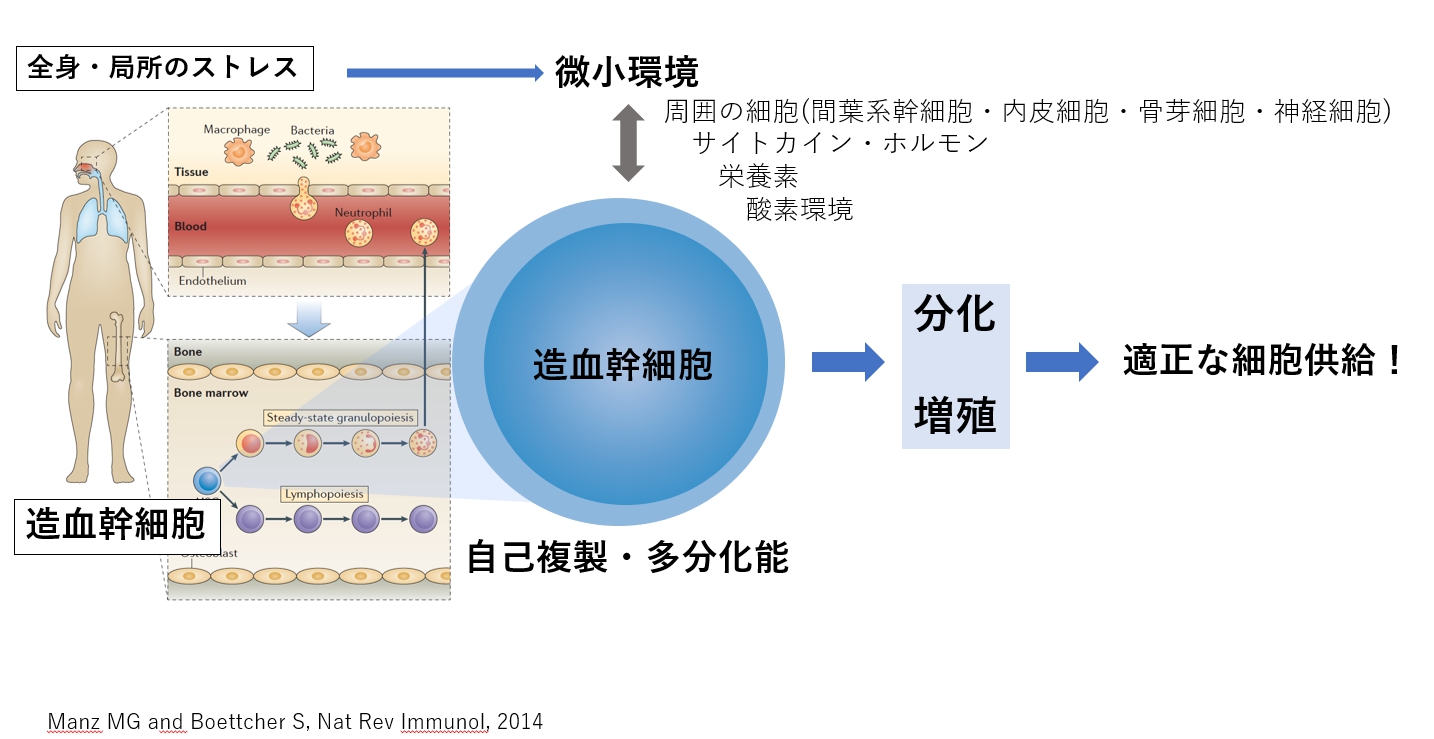
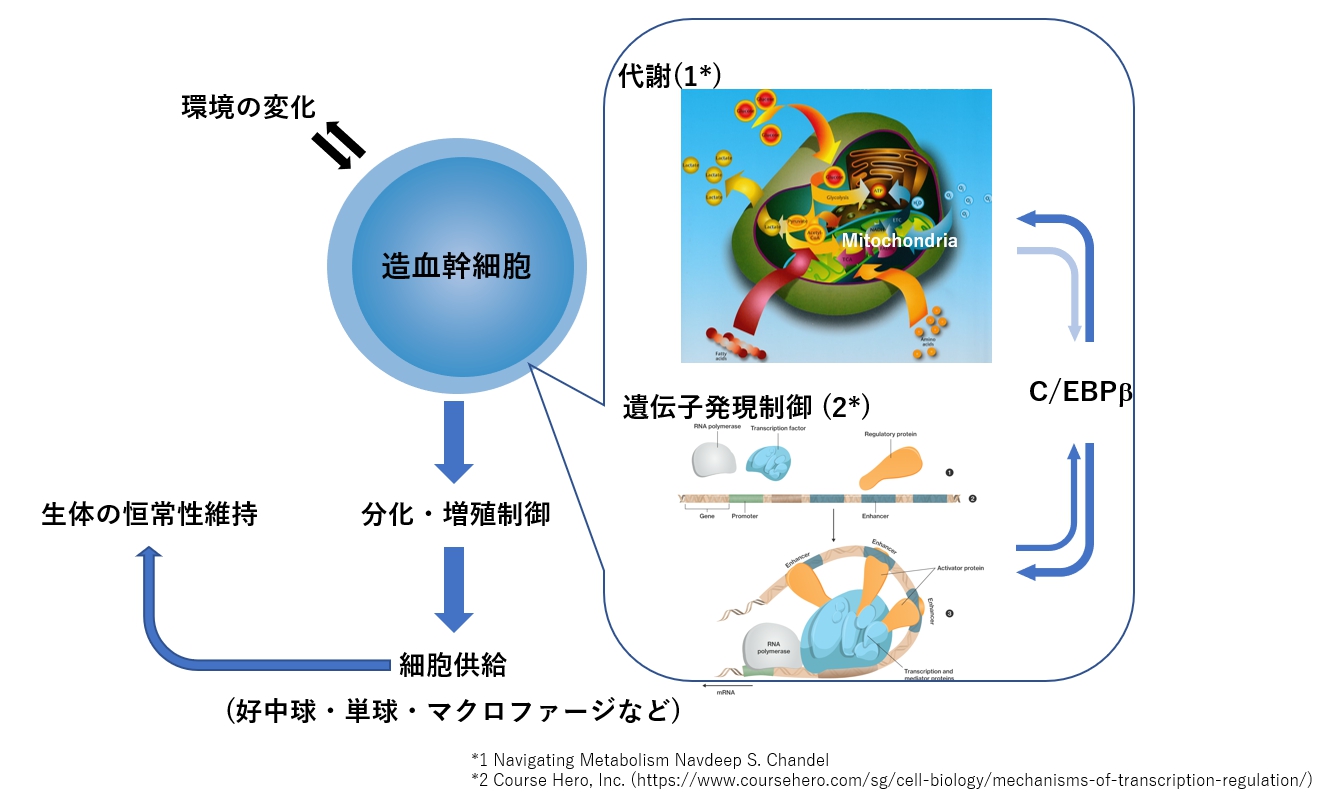
一方、私たちの体内の様々な組織に存在する組織幹細胞は、一般的には自己複製能と多分化能を兼ね備えており、生涯にわたって各組織の機能細胞を需要に応じて適切に供給することで生体の恒常性を維持しています。
私たちは、さまざまな血液細胞の中でも特に好中球・単球・マクロファージなどを造血幹細胞から産生する造血機構を主な研究の対象として、1) 環境の変化に応じた幹細胞の制御機構の解明、2) 様々なストレス負荷状態・疾患における幹細胞の機能的意義と制御機構、3) 幹細胞の制御が破綻した状態としての疾患の病態解明・治療・予防法の開発、4) 幹細胞の特性を生かした細胞療法・再生医療への展開を目指しています。
- 1) 環境の変化に応じた幹細胞の制御機構の解明環境の変化に応じて適切な数の好中球や単球・マクロファージを供給するために、造血幹細胞や前駆細胞の増殖や分化がどのように制御されているかを明らかにします。その中でも、造血幹細胞の代謝とクロマチン構造の変化を含む転写制御との関わりに注目しています。私たちは、これまでにC/EBPbという転写因子が感染症などで好中球を十分に供給するために重要な働きをしている事を明らかにしており、これを足掛かりにしてさらに詳細な分子メカニズムとともに造血制御の全体像を描けるような研究への展開を目指します。
- 2) 様々なストレス負荷状態・疾患における幹細胞の機能的意義と制御機構
感染症や炎症性疾患のみならず、代謝異常や、がん、老化などさまざまなストレスや疾患が造血に影響を及ぼすことが明らかとなっています。このようなストレスや疾患の状態を造血系がどのように感知し、反応するのかについて明らかにするとともに、そのような造血変化が、元のストレスや疾患の病態形成にもたらす意義について明らかにし、治療標的としての可能性についても明らかにします。 - 3) 幹細胞の制御が破綻した状態としての疾患の病態解明・治療・予防法の開発
白血病をはじめとした造血器腫瘍性疾患には幹細胞の制御機構に破綻が生じたものが多く含まれます。また、幹細胞の制御機構を巧みに利用した造血器腫瘍も存在しています。このような疾患の病態解明を通した治療戦略の開発を進めます。また、さまざまなストレス負荷時の造血変化が造血器腫瘍性疾患の発症のきっかけとなる可能性について検討するとともに、予防法についても明らかにしていきます。 - 4) 幹細胞の特性を生かした細胞療法・再生医療への展開
造血幹細胞はすでに、骨髄、動員末梢血幹細胞、臍帯血などの形で実用化されており、赤血球や血小板は輸血療法が確立している。一方で、好中球は生体防御においてきわめて重要な細胞であり、好中球減少時の重篤な感染症などでは緊急的に必要となるにも関わらず、細胞療法は十分に確立していません。好中球造血制御機構を十分に生かした臨機応変な細胞供給による生体防御細胞療法の確立を目指します。
🚩 伊東先生研究内容
日本人の死亡原因第一位は悪性新生物(がん)である。がんの原発巣が死に結びつくことはほとんどなく、「がん転移」による死亡が大部分を占める。進行したがん患者の多くで見られる「がん悪液質」とは、継続的筋肉量の減少を特徴とする進行性の栄養不良症候群である。全身状態を悪化させるため、悪液質はがん死亡の直接的な原因となっている。したがって、がん転移とがん悪液質を抑えることができれば、「がんと共存」できるかもしれないと考え、鍵を握るサイトカイン・Transforming
growth factor-β(TGF-β)に注目して研究をしています。
TGF-βは細胞膜上のI型とII型セリン・スレオニン受容体を介してシグナルを伝達しています。TGF-βは正常細胞の増殖を抑制しますが、がん形成後期にはTGF-βはがん細胞の増殖や転移を促進する作用もあります。がんは細胞増殖のブレーキが壊れている状態で、細胞は増殖を止めるためにTGF-βを過剰産生します。それゆえがん組織にはTGF-βが多く存在して、免疫細胞を抑制したり、がんの悪性化を促進したり、悪循環となっています。
👇👇👇 詳しい研究内容はクリックしてみてネ~❣❣
- Project1.腫瘍血行性・リンパ行性転移におけるTGF-βファミリーシグナルの役割
- Project2.血管の機能維持におけるTGF-βファミリーシグナルの役割(難治性血管疾患解析)
- Project 3.がん微小環境によるTGF-βファミリーシグナルへの影響
- Project4.ミオスタチンシグナル阻害によるがん悪液質改善
Project1.
腫瘍血行性・リンパ行性転移におけるTGF-βファミリーシグナルの役割 腫瘍組織にはTGF-βが多く存在します。TGF-βは上皮間葉転換を促進してがん細胞の遊走を促進して転移を促すことが分かっていますが、がん細胞の転移経路となる血管やリンパ管に対してどのような役割を果たすのか、詳細は明らかではありません。そこで腫瘍が転移するメカニズムを血管・リンパ管内皮細胞の側面から明らかにするために、TGF-βシグナル系分子の遺伝子改変マウスを用いて血管内皮細胞やリンパ管内皮細胞特異的にTGF-βファミリーシグナルを欠損させて腫瘍転移に与える影響を解析しています。
Project2.
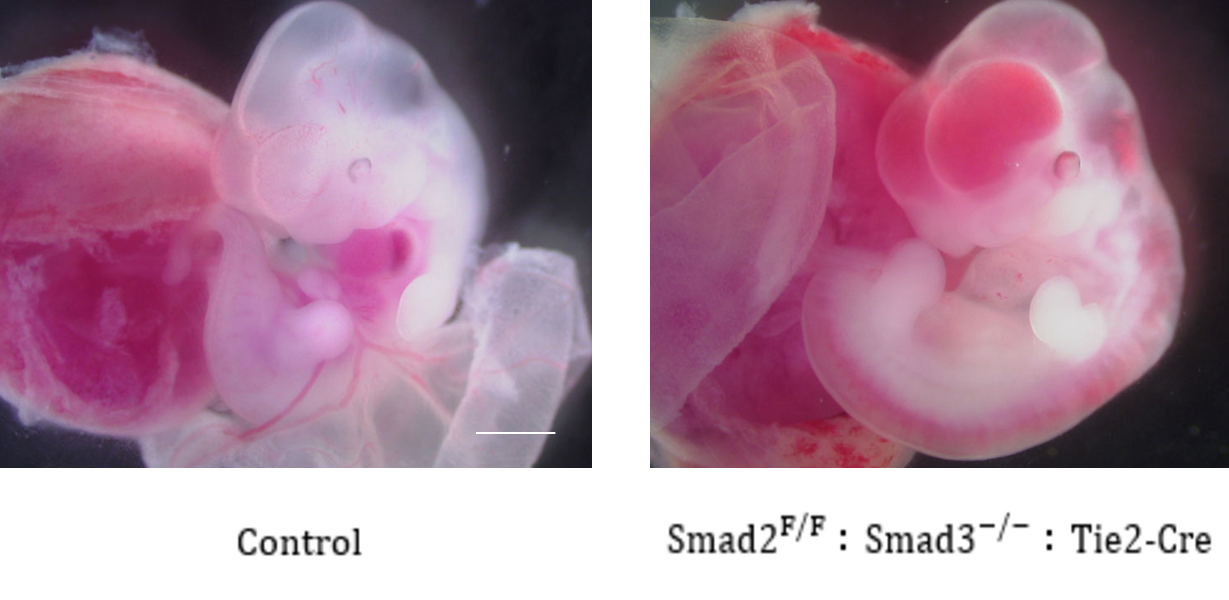
血管の機能維持におけるTGF-βファミリーシグナルの役割(難治性血管疾患解析)TGF-β、BMPを含むTGF-βファミリーは、生体の恒常性だけでなく血管の機能維持に必須のサイトカインです。内皮細胞特異的なTGF-βシグナル欠損マウスは、全身から出血して発生初期に死亡します(図、Itoh F. et al., Blood 2013)。GF-βファミリーシグナルの異常は、肺動脈性肺高血圧症(PAH)やオスラー病/家族性出血性毛細血管拡張症、マルファン症候群などの難治性血管疾患などの原因となることがわかっています。例えば、PAHの責任遺伝子としてBMPシグナルに関与する分子(BMPRII、ALK1、SMAD9、Endoglin)が同定されています。しかし、病態の発症メカニズムは明らかではなく、有効な治療法の開発が必要です。そこでTGF-βシグナル系分子の遺伝子改変マウスを用いて、難治性血管疾患の発症メカニズムの解明を目指しています。
Project3.
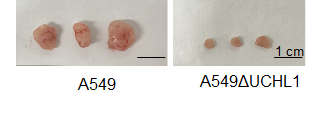
がん細胞は増殖が盛んであるため、酸素を多く消費し、腫瘍組織は低酸素状態に陥ります。私たちは低酸素環境がTGF-βシグナルを増強して転移を促進することを明らかにしました(Furuta C. et al., Cancer Sci. 2015)。さらに、低酸素環境が脱ユビキチン化酵素UCH-L1の発現を増強してSmadの分解を阻害し、TGF-βシグナルを増強するメカニズムを同定しました(Nagata A. et al., JBC 2020)。図のように、肺がん細胞・A549 のUCH-L1をノックアウトし細胞(A549ΔUCHL1)では腫瘍形成が抑制されることを報告しました。現在は腫瘍転移を促進するメカニズムについて、がん細胞側の原因を探索しています。
Project4.
ミオスタチンシグナル阻害によるがん悪液質改善TGF-βファミリーに属するサイトカイン、ミオスタチンは筋肉分化を抑制します。そのため、ミオスタチンシグナルの異常(阻害)は筋肉が増強されてムキムキになります。本学薬学部薬品化学研究室 教授 林良雄先生との共同研究により、ミオスタチンの前駆体に存在するミオスタチンシグナル阻害活性中心領域を同定し、ペプチド2と報告しました(Takayama T. et al., 2015 J. Med. Chem、特許JP2014/052345)。さらにPeptide-2はがん悪液質モデルマウスの筋肉分解を阻止し、QOLを改善することを見出しました(Ojima C. Cancer Sci. 2020)。現在、新たなミオスタチン阻害療法について解析を進めています。